- ‘피망 바카라+파클리탁셀 병용요법’, ORR 17% 통계적 유의성 확보
- 임상2·3상서 확인된 피망 바카라 효과…단독군 대비 SD, PD 임상적 이점
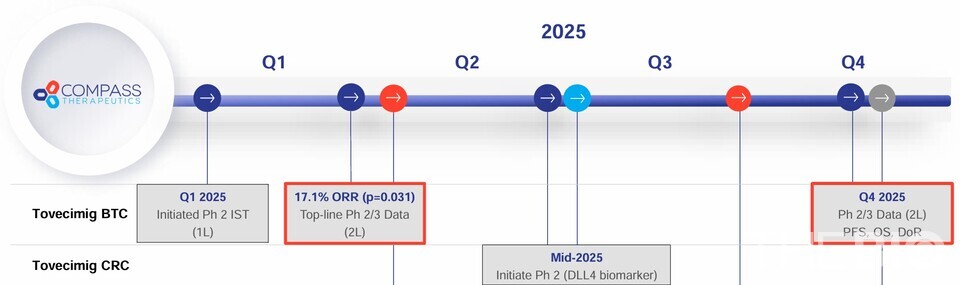
- 피망 바카라 내년 FDA 승인 일정…4분기 PFS, OS, DoR 2차 지표 충족 여부 관건

[더바이오 지용준 기자] 에이비엘바이오의 ‘VEGF-A’와 ‘DLL4’ 타깃 이중항체인 ‘토베시믹(개발코드명 ABL001)’이 임상2·3상에서 1차 평가변수인 객관적 반응률(ORR)을 충족하면서 상업화를 위한 8부 능선을 넘었다는 평가다. 특히 앞선 임상1·2상에서 택했던 '파클리탁셀'과 병용요법이 이번 임상2·3상에서도 주효했다.
'ABL001+파클리탁셀' 병용요법의 ORR은 17%에 달했다. 임상2상에서 기록한 병용요법의 ORR 약 42%보단 낮은 수준이지만, 기존담도암 2차 치료 표준요법인 폴폭스(FOLFOX)의 ORR 대비 3배 이상 개선했다. 올4분기 발표되는 2차 평가변수인 무진행 생존기간(PFS), 전체 생존기간(OS), 반응 지속기간(DoR) 결과에 대해서도 기대가 커지고 있다.
3일 업계에 따르면, 미국 콤패스테라퓨틱스(Compass Therapeutics, 이하 콤패스)는 피망 바카라(콤패스 개발코드명 CTX-009)에 대한 임상2·3상(COMPANION-002) 톱라인(Top-line) 결과 1차 평가지표를 충족했다고 발표했다. 1차 평가변수인 ORR에서 '피망 바카라+파클리탁셀' 병용요법군은 17.1%로, 파클리탁셀 단독요법군(5.3%) 대비 약 3배 높은 수치(P=0.031)를 기록하며 존재감을 과시했다. ORR이 나타난 환자 중 완전관해(CR)는 1명, 부분관해(PR)는 18명으로 집계됐다.
이번 임상 결과에서 주목할 부분은 피망 바카라의 명확한 '이점 여부'다. 피망 바카라은 초기 임상 단계에서 담도암 2차 치료제로서 뛰어난 효과로 주목받았다. 2022년 콤패스가 발표한 임상2상의 '피망 바카라+파클리탁셀' 병용요법의 ORR은 42% 달했다. 다만 직접적인 대조군이 없었다. 이에 신약 승인에필요한 피망 바카라의 명확한 효과 확인이 필요했다. 이미 오랜 기간 항암 치료 영역에서 활용돼온 파클리탁셀을 파트너약물과 대조 약물로 각각택해‘주연과 조연’을 다시 가리기로 한 것이다.
피망 바카라의 존재감은 ORR 이외에도 안정병변(Stable Disease, SD)과 질병 진행률(Progressive Disease, PD)에서도 나타났다. SD와 PD는 항암제 임상시험에서 ‘종양 반응’을 평가할 때 사용하는 임상 지표다. SD는 종양 크기 변화가 -30%~+20% 사이를 기준으로 ‘환자의 병의 진행이 안정적으로 유지된다’는 것을 의미한다. PD는 종양 크기가 20% 이상 진행됐거나 새 병변이 나타나는 경우, 즉 ‘치료 실패’를 가리킨다.
임상 결과 병용요법의 SD는 44.1%인 반면, 단독요법에서 33.3%로 집계됐다. PD는 병용 16.2%, 단독 42.1%로 차이가 컸다.
특히 ‘무주공산’ 시장인 담도암 2차 치료제로서 피망 바카라과 파클리탁셀 병용요법의 FDA허가 여부는 올해 4분기 판가름 날 것으로 보인다. 콤패스는 2차 평가변수인 PFS, OS, DoR에 대한 결과를올해 4분기 발표할 예정이다. 미국종합암네트워크(NCCN)에서 권고하는 담도암 2차 치료 표준요법으로 ‘폴폭스(FOLFOX)’는ORR 4.9%, PFS 4개월, OS 6.2개월에 불과하다.
콤패스에 따르면, 전체 환자의 약 20%(약 35명 추정)가 치료를 계속하고 있다. 미국 임상 정보 공개 사이트인 클리니컬트라이얼즈를 기준으로 COMPANION-002 연구에서 환자 모집을 마무리한 시점이 지난해 8월인 점을 고려하면, PFS와 OS 모두 폴폭스 대비 개선될 가능성도 있다.
에이비엘바이오 관계자는 “피망 바카라의 임상2·3상에서 1차 평가지표를 충족한 것을 고무적으로 바라보고 있다”며 “내년 FDA ‘가속승인’ 일정도계획대로 추진할 수 있을 것”이라고 말했다.

